序章
多くの国で家禽飼料における抗生物質成長促進剤(AGP)の使用の禁止または拒否、ならびに治療上の抗生物質の使用に対する規制の強化は、「腸の健康」または「抗生物質」は、家禽産業および研究の集合的な用語集で非常に一般的になっています。www.modernagriculturefarm.com飼料にAGPが含まれていないと、感染症に必ずしも関連するのではなく、食事要因に対する炎症反応に関連する根本的な腸の問題が明らかになります。
私たちの時代では、 AGPに取って代わる動機で開発された多くの飼料添加物があります。しかし、 考えられる添加剤の混合物が多数ある場合でも、 基礎食の組成とその成分の品質は、間違いなくAGPフリーの生産システムで重要な役割を果たしています。この文脈では、 大豆ミール(SBM)の品質、 世界中のあらゆる家禽飼料の重要な成分、 飼料中の抗栄養因子(ANF)の寄与は、腸の機能と健康を大いに欲しがる可能性があります。 その結果、 鶏の発達と成長。
記事上で、 飼料成分が鶏の腸の問題の原因となる可能性と、それらがこれらの問題をカバーするAGPの作用機序を確認します。家禽サイトの次の号では、 鶏肉飼料中の大豆の抗栄養因子を減らすことの重要性に取り組みます。 AGPがなくなったとき。
炎症と酸化ストレスは鶏の腸の病気の根源にあります
炎症反応と酸化ストレスは、ブロイラーの一般的な腸の障害に関与しています。腸の炎症は、実際には自然免疫の一般的な反応です。 有害な刺激に対する複雑な宿主防御システムの一部。鶏の腸の炎症は感染症だけが原因ではないことに注意することが重要です。したがって、 Kogut et al(2018)は、次のように指摘しています。 (感染による)急性の病理学的炎症に加えて、 鶏の腸の炎症の最も再発する種類の1つは無菌炎症です。これは、非感染性の刺激による軽度の慢性炎症です。 そして、ほとんどの場合、フィードに存在する特定のANFに対してです。この意味で、 抗原ベータコングリシニン、 大豆粕に含まれる、 穀物グルテンプロラミンと同様に、腸の炎症を引き起こす可能性があります。これは、腸内のいくつかの炎症誘発性サイトカインの発現と産生の増加によって媒介されているようです、 腸上皮における密着結合タンパク質の発現の変化、 およびアポトーシス(Chen et al、 2011; De PunderとPruiboom、 2015;鵬ら、 2018)。食事由来の無菌性炎症の他の引き金は、ある程度の酸敗を伴う脂質です。 粘膜の炎症の強力な誘導物質である活性酸素種(ROS)の重要な供給源であり、 この記事の後半で説明します。したがって、 飼料に添加される油脂の品質、 脂質含有量の高いすべての生の動物由来材料の品質(例: 魚粉、 家禽副産物ミール)は、飼料誘発性の無菌性炎症(マブロミカリス、 2019)。
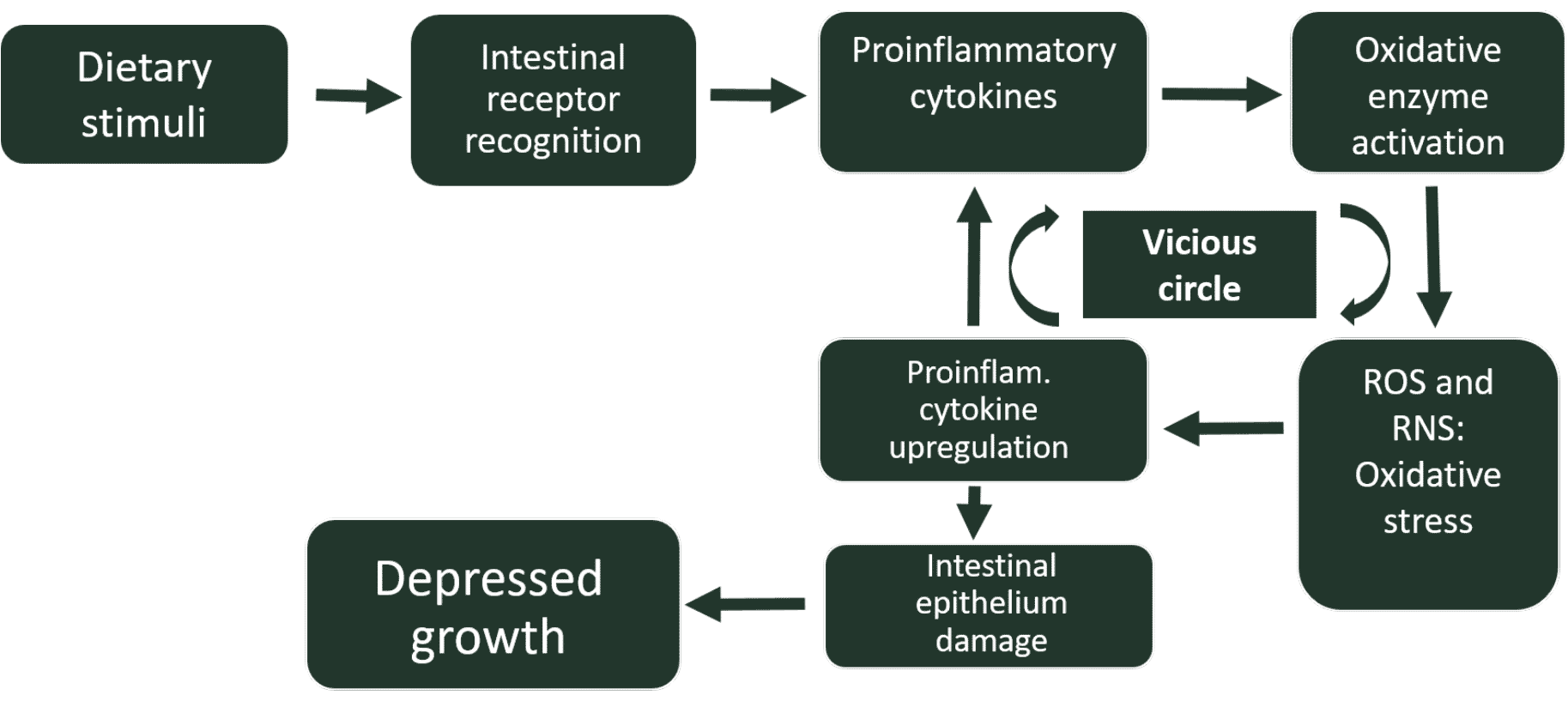
炎症反応の間、 食作用性免疫細胞は、ROSや活性窒素種(RNS、 例えば一酸化窒素)、 酸化酵素NADPHオキシダーゼ(NOX)および一酸化窒素シンターゼ(iNOS)が活性化されると、 それぞれ、 両方とも、炎症過程の枠組みの中で分泌される炎症誘発性サイトカインによって誘発されます(Tian et al。、 2017)。したがって、 どんな種類の腸の炎症もROSとNOSを生成します、 これは腸内の酸化ストレスの状態につながります。これらのフリーラジカルは抗菌特性を示しますが、炎症中に組織の損傷を引き起こす可能性もあります。この点について、 ROSとRNSはどちらも、炭水化物の細胞内損傷の原因となる主要なメディエーターです。 タンパク質、 脂質、 と核酸、 不対電子による不安定な条件のために反応性が高い(Lauridsen、 2019)。
さらに、 この炎症に関連する酸化ストレスは、いくつかの細胞の表現型を変更する可能性があります、 特定の遺伝子の発現に変化をもたらします。例えば、 腸内の酸化ストレスの条件下で、 いくつかの炎症誘発性サイトカインの発現のアップレギュレーションがあります、 オクルディンとムチン2のダウンレギュレーションと同様に。 腸上皮の完全性に関与する分子(Ducatelle et al.2018)。したがって、 腸の炎症中に発生する酸化ストレスは、これらの炎症の重症度を高めます、 悪循環に入る、 克服するのは難しい、 これは慢性炎症状態の確立につながります、 成長の衰退などの重大な望ましくない生物学的結果を伴います(図1)。一方で、 前述のように、 炎症に由来し、酸化ストレスを誘発することは、酸敗した脂肪が豊富な動物由来の飼料成分を含めることによってさらに悪化する可能性があります。 ニワトリの腸で追加の酸化カスケードを開始します、 炎症性サイトカインの分泌を増加させます。
<図>
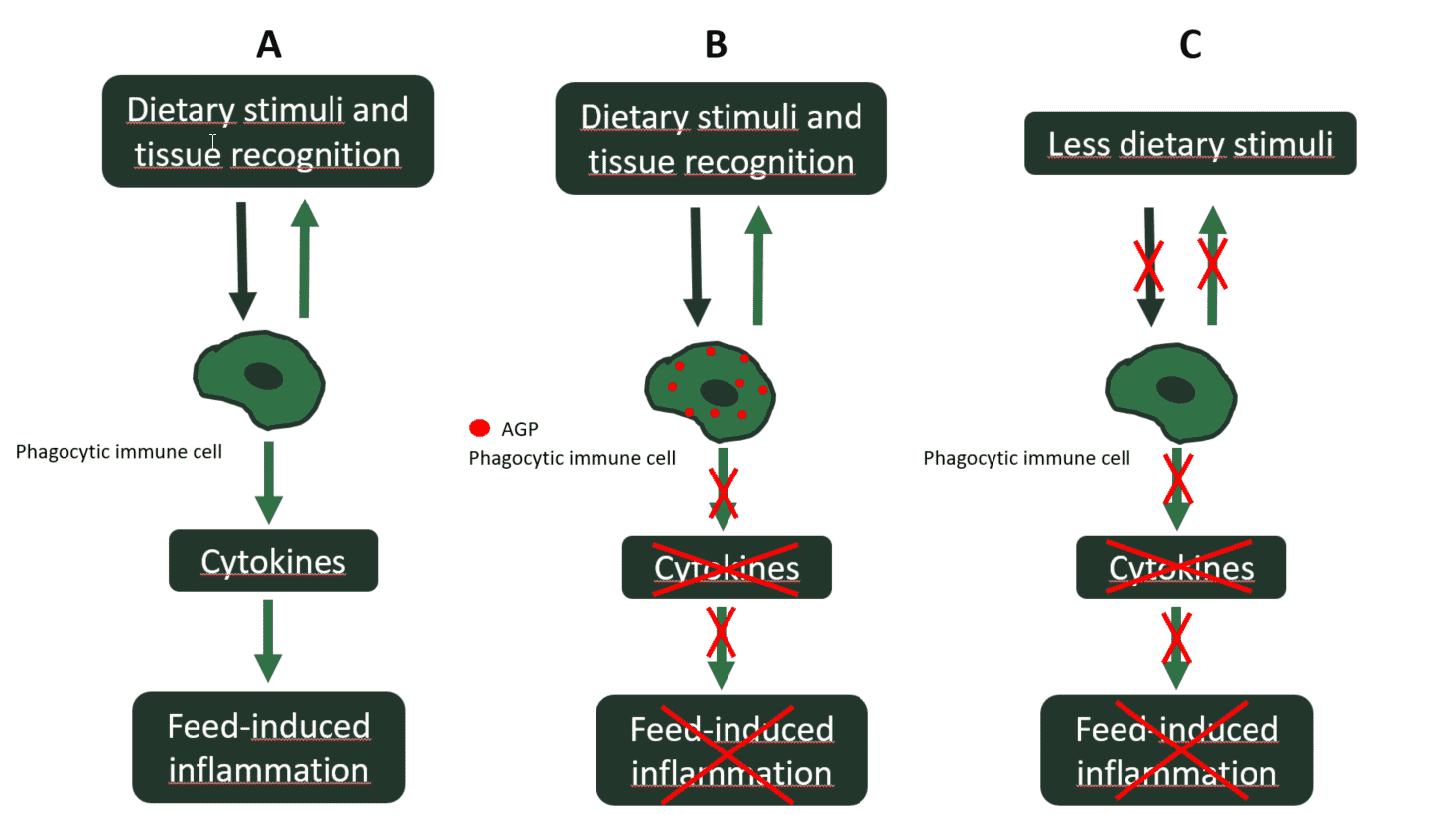
この種の腸の障害は、以前は炎症を誘発する飼料成分にナイーブだったヒヨコでより顕著です。したがって、 若いひよこは、未熟な腸に存在する日和見細菌性病原体によって複雑化する可能性のある炎症反応を介して反応します。しかし、 AGPがフィードに追加されると、 このような飼料誘発性の炎症反応は、AGPの抗炎症効果によって軽減されます。
AGPの抗炎症効果
近年では、 AGPの抗菌効果が疑問視されています、 それらが腸管腔で到達する濃度は治療量以下であり、したがって病原体の最小発育阻止濃度よりも低いためです。さらに、 AGPの中断のない使用は、病原体に抗生物質耐性を誘発します。それどころか、 AGPの抗炎症効果、 それらの主な作用機序として、 関連性を増しています。多くの抗生物質に実際に共通しているのは、それらが炎症細胞に蓄積することです。その結果、 ほとんどの蓄積された抗生物質は、腸内の自然免疫応答の食細胞性炎症細胞を阻害することができます。食細胞におけるこの蓄積の関連する結果は、炎症反応の減少です。したがって、 炎症性サイトカインのレベルは、AGPで治療された動物では低くなります。 その結果、異化作用の誘発が低下します。 典型的な炎症(Niewold、 2007)。言い換えると、 AGPは、ニワトリの成長を遅らせる炎症反応を抑制します。したがって、 フィードにAGPがない場合、 飼料によって誘発された無菌の炎症が再び現れます。良い戦略は、基礎食中の食事刺激(例:ANF)の量を減らすことによって、そのような飼料誘発性炎症の発生を事前に最小限に抑えることです。 腸に落ち着いたらAGPで軽減する代わりに(図2)。
結論は、 鶏の飼料誘発性の無菌性炎症と酸化ストレスは、かなりの数の成分に起因する可能性があります。結果として生じる炎症-酸化ストレスの悪循環は、健康とパフォーマンスを損ないます。したがって、 AGPを含まない飼料に、炎症を刺激する可能性のある成分が含まれていないことを確認する必要があります。 少なくとも、 飼料中の抗栄養因子の量を可能な限り減らす必要があります。これは、(プレ)スターターフィードで特に重要です。前述の悪循環を芽に挟むのが早ければ早いほど、 よりいい。 <図>