魚の種は魚の養殖にとって最も重要な要素です。www.modernagriculturefarm.comわが国の魚の養殖のための淡水資源は、285万ヘクタールの池と水槽であると推定されています。それに加えて、 さらに205万ヘクタールの水域が、貯水池または湖の形で利用できます。 5000稚魚/ haの控えめな放流率で、現在利用可能な285万ヘクタールでさえ、1億4250万羽近くの稚魚が放流に必要であると推定されています。現在の生産量は1億5700万稚魚です。これから離れて、 湖や貯水池の利用可能な面積を2000稚魚/ヘクタールの平均放流率で放流するには、少なくとも4億稚魚の追加量が必要です。これは、利用可能な水資源を蓄えるために稚魚を育てる必要があることを示しています。
魚の種は3つのソースから得られます– Riverine、 孵化場と房。河川の水源からの種子の収集は、古くからの慣習でした。この方法は骨の折れる作業であり、必要な魚の種と不要な魚の種が混ざり合っています。孵化場は魚の種を得る最良の方法です。これらとは別に、 外灘の繁殖は、自然の生息地を作ることによって魚の種を集める良い方法でもあります。
インドのさまざまな水系は、魚の動物相の分布と豊富さに関して変化を示しています。これは主に彼らの個々の生態学的条件によるものです、 グラデーションなど、 地形、 フロー、 深さ、 温度、 基層、 北部の川は多年生であり、豊かな商業漁業を支えています。デルタ地域を除いて、 半島の川の漁業は、上流と中流の両方で貧弱です。
1 私 NS デュ NS e NS NS NS eed 私 NS NS NS e NS NS 番号 l o NS y
鯉は川のような流れる水で繁殖します。当然、彼らは限られた水域で繁殖することはありません。天然資源から収集された種子は、一般的に、望ましい品種と望ましくない品種の両方を含む混合ストックです。混合株からの望ましい種子の分離は大きな問題です。取り扱いにより、 望ましい品種は死ぬかもしれません。捕食性の魚の種が見つかった場合、 彼らは望ましい魚の種を傷つけます。もう1つの大きな問題は、自然なコレクションで必要な数を取得できないことです。純粋なシードの入手は非常に困難です。これらすべての問題を克服するために、誘発された繁殖は、純粋で必要な魚の種を得るための優れた技術です。これにはいくつかの利点があります。誘導育種により、望ましい種の純粋な種子を得ることができます。ローフーシードが必要だとしましょう。 数日で生産できるのはローフーシードだけです。この手法で必要な数のシードを生成できます。養魚場に1カロールの魚の種が必要だとします。 この数は、非常に簡単に短時間で作成できます。シードの識別と分離の問題は発生しません。このテクニックはとても簡単です。健康な種子を生産することができます。魚は1年に複数回産卵することができます。ハイブリダイゼーションが可能です。
誘導育種技術では、 魚に注射を行うために使用される材料の4つの主要なタイプ-下垂体の抽出、 HCG、 ovaprimとovatide。
Ind u ce NS ブリーディン NS 機転 NS 円周率 NS uitar y グラン NS Extr NS ctio NS
下垂体抽出による魚の繁殖は、栽培可能な魚の純粋な種子を取得するための効果的で信頼できる方法であり、今日、インドだけでなく世界の他の多くの国でもかなり大規模に実施されています。それは、成熟した雌と雄の魚に、他の成熟した魚から採取した下垂体の抽出物を注入することを含みます。
NS istori NS NS l 戻る NS 円形:
脊椎動物の繁殖における下垂体の役割の現在の概念は、下垂体インプラントが雌マウスの性的発達を加速することを発見した1927年のアシュハイムとゾンデクの実験に端を発していると報告されています。 3年後、 1930年、 アルゼンチンのHoussayは、魚に対して最初のそのような実験を行いました。彼は小さな胎生ナマズを注射しました、 別の魚から調製された下垂体の抽出物を含むCresterodondecammaculatus、 Prochilodusplatensisは発育中の若年者の早産をもたらします。 1934年、 成功した技術は、他のあまり価値のない魚種から集められた新鮮な下垂体の懸濁液をそれらに注入することによって産卵させられた特定のブラジルの池でフォン・イリングによって解決することができました。ブラジル人、 したがって、 魚の繁殖技術を最初に使用したのは、下垂体形成による成功でした。 1937年、 ロシアの科学者Gerbiskiiは、かなりの数のチョウザメを誘導することに成功しました。 チョウザメ。
インドは、この技術をその心理文化的プログラムの不可欠な部分にした世界で3番目の国です。インドでの最初の催眠術の試みは、1937年にハミド・カーンが哺乳類の下垂体の注射によってCirrhinusmrigalaに産卵を誘発しようとしたときに行われました。次の試みは、1945年にフセインによって80-120 RVProlanやAntuitrin-Sなどの特定のホルモンを使って雌のLabeorohitaとCirrhinusmrigalaに行われた。 1955年、 Hiralal Choudhuriは、Catla catlaの下垂体抽出物の腹腔内注射により、Esomusdanricusの産卵を誘導することに成功しました。彼はまた、Pseudotropiusatherinoidesの繁殖にも成功しました。 RamaswamyとSunderarajは、それぞれ1955年と1956年にHeteropneustesfossilisとClariasbatrachusの繁殖に成功しました。催眠術によるインドの主要なコイの誘導繁殖における最初の成功は、1957年にCIFRIのHiralalChaudhuriとAlikunhiによって達成されました。 カタック。
フィス NS NS 私 tuit NS NS y グラ NS NS :
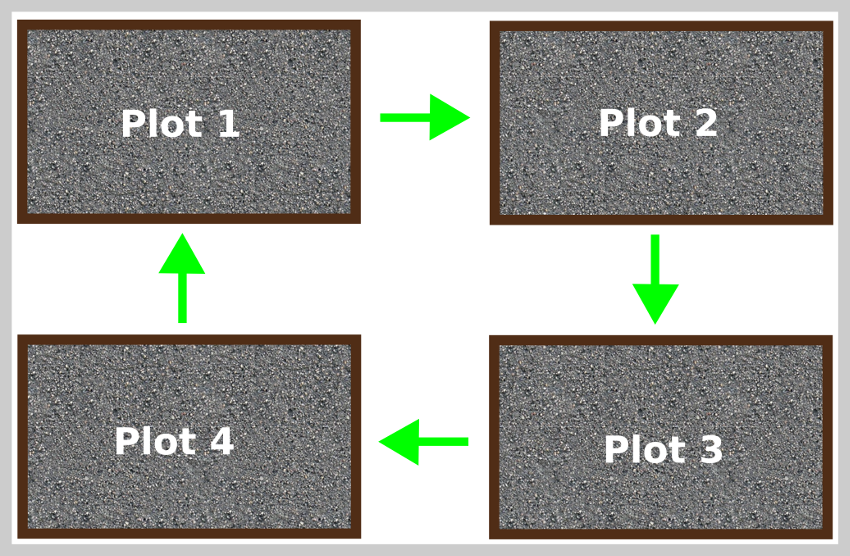
魚の下垂体は小さいですが、 柔らかなボディとクリーミーな白。コイでは多かれ少なかれ丸いです。それは、脳ボックスの床の凹面にある視交叉の後ろの脳の腹側(図3.1)にあります。 トルコ鞍として知られ、硬膜と呼ばれる薄い膜で囲まれています。いくつかの魚では、それは細い茎によって脳に付着しています、 下垂体茎として知られています。下垂体茎部に基づいて、 腺は2つのタイプに分類されます、 つまり、 platybasic –茎なし、 開いた漏斗状のくぼみと下垂体茎部があり、茎があり、 下垂体茎部を全滅させた。下垂体のレプトバシックタイプはコイに見られ、プラティバシックタイプはライギョとライギョに見られます。腺の大きさと重さは、魚の大きさと重さによって異なります。ラベオロヒタでは、 下垂体の平均体重は1〜2kgの魚で6.6mgです。 2〜3kgの魚に10.3mg、 3〜4kgの魚で15.2mg、4〜5kgの魚で18.6mg。
下垂体は性腺刺激ホルモンを分泌します、 FSHまたは卵胞刺激ホルモン、 およびLHまたは黄体形成ホルモン。両方のホルモンは一年中分泌されます、 しかし、それらが分泌される割合は、性腺の成熟のサイクルと直接相関しています。 FSHは、女性の卵胞の成長と成熟、および男性の精巣の精子形成を引き起こします。 LHは、女性の卵胞を黄体に変換し、男性のテストステロンの生成を促進するのに役立ちます。これらのホルモンは種特異的ではありません、 NS。、 ある種から得られたホルモンは、別の魚の性腺を刺激することができます。しかし、 種によってその有効性には大きなばらつきがあります。魚の誘導育種で実施された実験は、哺乳類の下垂体ホルモンに対する魚の下垂体抽出物の相対的な有効性を明確に示しています。 性ホルモンおよびさまざまなステロイド。これが、今日、世界中の魚の繁殖作業で魚の下垂体が広く使用されている理由です。
コレクティ o NS o NS Pituitar y 腺 :
下垂体を提供する魚、すなわち、 下垂体が集められる魚はドナー魚と呼ばれます。誘導された魚の繁殖の成功は、ドナー魚の適切な選択に大きく依存します。腺は、できれば完全に熟した妊娠中の魚から収集する必要があります。 腺は繁殖時または産卵直前に最も強力であるためです。腺の効力は産卵後に減少します。未熟な魚や使用済みの魚から集められた腺は、通常、満足のいく結果をもたらしません。産卵直後に採集された誘導繁殖魚の腺も効果的であり、他の魚の繁殖に使用できることがわかっています。主要なコイの下垂体の収集にインドで最も適した時期は、5月から7月の間です。 鯉の大多数はこの期間中に成熟の進んだ段階に達するので。コイ以来、 Cyprinus carpioは多年生のブリーダーであり、 その成熟した個体は、腺の収集のためにほぼ一年中入手することができます。腺は通常、殺されたばかりの魚から収集されることが好ましいが、氷で保存された標本から収集されたものも使用される。
さまざまな国で下垂体を収集するために、いくつかの手法が採用されています。インドで、 腺収集の一般的に採用されている技術は、肉屋のナイフの斜めのストロークによって魚の頭蓋骨の頭皮を切り落とすことです。頭皮を取り除いた後、 脳の上にある灰白質と脂肪物質は、綿でやさしくきれいにされます。このように露出した脳は、神経から切り離すことによって注意深く持ち上げられます。コイ科の大多数では、 脳が持ち上げられると、 腺は脳の箱の床に残されています。次に、腺を覆っている硬膜を、細い針と鉗子を使用して慎重に取り除きます。露出した腺は、損傷したり壊れたりすると効力が失われるため、損傷を与えることなく無傷で拾い上げられます。
腺も大後頭孔を通して集められます。です、 実際には、 混雑した騒々しい魚市場での大規模な収集のために専門家によって一般的に実践されている、はるかに簡単な腺除去の方法。この腺の収集方法では、 魚は本質的に頭を下げる必要があります。市場では、 腺は、小売業者によってすでに切断されている魚の頭から収集されます。カットされた魚の頭では、 灰白質と脂肪物質を含んでいる後ろから、孔がはっきりと見えます。脳は孔の腹側にあります。腺を取り出すために、 灰白質と脂肪性物質は、鉗子の平滑末端を孔に挿入し、脳を乱すことなく物質全体を引き出すことによって最初に除去されます。脳は注意深く持ち上げられて前方に押されるか、穴から引き出されます。次に、脳の箱の床にある腺を、細いピンセットを使って拾い上げます。実験作業員は、この収集技術を採用することで、1時間で約50〜60個の腺を簡単に収集することができます。
NS 予約 o NS Pituit NS NS y 腺 NS :
集められた腺がその場で使用するためのものでない場合、 それらは保存する必要があります。それらの糖タンパク質またはムコタンパク質の性質のために、 それらは即時の酵素作用を受けやすい。下垂体は3つの方法で保存することができます-絶対アルコール、 アセトンと凍結。インドでは、無水アルコールで魚の下垂体を保存することが好まれています。さらに、 インドの主要なコイのアルコール保存腺でこれまでに行われた実験は、アセトン保存腺よりも肯定的な結果をもたらしました。
収集後の腺は、脱脂と脱水のためにすぐに無水アルコールに入れられます。各腺は、識別を容易にするために連続してマークされた別々の小瓶に保管されます。 24時間後、 腺は無水アルコールで洗浄され、濃い色のボトルに入った新鮮な無水アルコールに再び保存され、室温または冷蔵庫で保管されます。アルコールを時々交換することで、腺を長期間良好な状態に保つことができます。水分が薬瓶の中に入るのを防ぐために、 それらは、無水塩化カルシウムを含むデシケーター内に保管することができます。腺は冷蔵庫に保管しておくことが望ましいです。冷蔵庫で2〜3年、室温で1年まで保存できます。
アセトンも優れた防腐剤です。この方法では、 収集後すぐに、 腺は、新鮮なアセトンまたはドライアイスで冷やしたアセトンに入れて冷蔵庫内で100°Cで36〜48時間保持します。この期間中、 適切な脱脂と脱水のために、アセトンを約8〜12時間間隔で2〜3回交換します。次に、腺がアセトンから取り出されます。 ろ紙の上に置き、室温で1時間乾燥させます。その後、100℃の冷蔵庫に保管されます。 好ましくは、塩化カルシウムまたは他の任意の乾燥剤を充填したデシケーター内。アセトンでの腺の保存は、主にソ連と米国で行われています。
NS 賠償 o NS ピトゥイタ NS y Gl NS NS NS E xtract :
次に、保存された腺の重さを量ります。これは、ブリーダーの体重に応じて与えられる用量を正確に決定するために不可欠です。腺の重量は、個別に、またはグループで測定できます。より正確な重量を取得するには、 アルコールから腺を取り出してから2分後に、腺の重さを正確に測定する必要があります。
下垂体抽出物は、注射の直前に準備する必要があります。注入に必要な腺の量は、最初に注入されるブリーダーの重量から計算されます。次に、腺が選択され、必要な量の腺がバイアルから取り出されます。アルコールを蒸発させ、 腺がアルコールで保存されているものである場合。アセトンで乾燥させた腺は、浸軟のためにバイアルからすぐに取り出されます。
次に、測定された量の蒸留水または一般的な塩溶液、またはレシピエントの魚の血液と等張である任意の生理学的溶液を加えることによって、腺を組織ホモジナイザーで浸軟させる。インドの主要なコイで誘発された繁殖の最も成功した結果は、これまで蒸留水と0.3%食塩水で得られました。抽出物の濃度は通常、培地0.1mlあたり1〜4mgの腺の範囲に保たれます。 20-30グラムの割合で。 1.0mlの培地中の腺の。均質化後、 懸濁液を遠心分離管に移します。転送中、 ホモジネートをよく振って、溶液と混合されている沈降した腺粒子が遠心分離管に入るようにする必要があります。チューブ内の抽出物を遠心分離し、上澄み液を皮下注射器に吸引して注射します。
下垂体抽出物は、魚の繁殖期の前に大量に調製してグリセリン(抽出物1部:グリセリン2部)で保存することもできるため、注射前に毎回抽出物を調製する煩わしさを回避できます。ストック抽出物は、常に冷蔵庫または氷に保管する必要があります。
NS e NS NS niq u e o NS NS リー NS NS :
主要なコイの誘発された繁殖操作は、通常のモンスーンが始まるときに取り上げられます。 魚は完全に熟し、水温が下がります。ラウンドを持っている女性、 赤みを帯びた通気孔が膨らんだ柔らかく膨らんだ腹部と、白子が自由ににじみ出るオスが繁殖のために選ばれます。男性のブリーダーは、胸鰭の背面の粗さによっても簡単に区別できます。
1 。 行う NS ag e o NS ピトゥイ NS ar y extr NS NS NS :
魚の誘発繁殖の最も重要な側面は、下垂体抽出物の適切な投与量の評価です。腺の効力は、ドナーの性的発達のサイズと段階によって異なります、 ドナー魚の種と同様に、 腺の収集とそれらの適切な保存の時間。下垂体の投与量は、注入されるブリーダーの体重に関連して計算されます。同様の体重のブリーダーに同じ用量を投与すると、性腺の成熟度が異なるため、矛盾した結果が得られる可能性があることにも気づきました。性腺が吸収段階にある場合は、大量のホルモンでさえ効果がない可能性があります。ブリーダーを注意深く選択し、ブリーダーの体重1kgあたり下垂体抽出物の既知の重量を投与することにより、 繁殖に成功することができます。
用量の標準化に関する実験は、雌のブリーダーに予備的な低用量を投与し、その後6時間後により高い有効用量を投与すると、単回ノックアウト用量よりも成功することが証明されていることを示しています。ブリーダーが理想的な状態にあり、天候が良好な場合は、1回の高用量が有用であることがわかっています。 Rohuは2回の注射によく反応し、catlaとmrigalは1回と2回の注射の両方に反応します。
2〜3mgの割合での初期用量。魚の体重1kgあたりの下垂体の量は雌のブリーダーにのみ投与されます。男性のブリーダーは初期投与を必要としません、 彼らが腹部にわずかな圧力でミルトをにじみ出させた場合。それぞれのメスに対して2匹のオスが繁殖セットを作ります。良いマッチングセットを作るために、 男性を合わせた体重は、女性と同じかそれ以上でなければなりません。自由ににじみ出る段階で2匹のオスのいずれかの状態が見つからない場合、 最初の注射は、2〜3 mg / kg体重の割合で雄に投与することができます。 6時間後、 5〜8 mg / kg体重の2回目の投与が女性に与えられます。 一方、両方の雄は2〜3 mg / kg体重の割合で1回目または2回目の投与を受けます。ブリーダーの成熟状態や一般的な環境要因に応じて、投与量をわずかに変更する場合があります。化学的バランスがない場合、 1〜3個の下垂体は1対の魚に効果的です。
2 。 NS e トー NS o NS 注入 :
頭蓋内注射はソ連では好まれ、腹腔内注射は米国と日本で好まれます。筋肉内注射は、インドで最も一般的な方法です。筋肉内注射は、他の方法と比較してリスクが低くなります。腹腔内注射は通常、体の柔らかい領域を通して行われます。 一般的には骨盤鰭の付け根、時には胸鰭の付け根にあります。しかし、内臓に損傷を与えるリスクがあります。 完全に成熟した魚に腹腔内注射を行う場合は特に、膨張した性腺。
注射は通常、背びれの付け根近くの尾柄または肩の領域に行われます。コイに注射をしている間、 針は、最初は魚の体と平行に保たれたまま鱗の下に挿入され、次に斜めに筋肉に突き刺されます。注射の時間に関して厳格な規則はありません。注射は昼夜を問わずいつでも行うことができます。しかし、低温が役立ち、夜間は比較的静かなままなので、 注射は通常、午後遅くまたは夕方にタイミングを合わせて行われます。
シード 製造 NS 技術 33
魚が邪魔されない産卵のために夜の静寂を使うことができるように調整されました。
この目的で使用される最も便利な皮下注射器は、0.1ccの目盛りを持つ2ccの注射器です。注射器の針のサイズは、注入するブリーダーのサイズによって異なります。 No. 22針は、1〜3kgのコイに便利に使用されます。 大きなコイには19番、小さなコイには24番を使用できます。
注射中に麻酔薬を使用すると、ひな魚の生存率が大幅に向上します。一般的に使用される麻酔薬はMS222とキナルディンです。 MS 222は、50〜100 mg /リットルの用量で水に添加することができます。この溶液0.04Mに浸した綿のロールを魚の口に挿入することができます。キナルディンは50-100mg /リットルの割合で使用されます。
3 。 NS リードイン NS NS ap NS NS NS スパ w ニング :
注射後、 ブリーダーは繁殖ハパのすぐ内側で解放されます。繁殖用ハパは通常、大型のブリーダーの場合は3.5 x 1.5 x 1.0 m、体重が3kg未満のブリーダーの場合は2.5x 1.2 x 1.0mのサイズの細かい布でできています。ブリーダーを内部に導入するための上部の部分を除いて、繁殖ハパのすべての側面が縫い合わされて閉じられています。一般的、 各繁殖ハパ内で1セットのブリーダーがリリースされます。 でも時々、 下垂体材料を節約するために、 コミュニティブリーダーは、オスのブリーダーの数を減らすことによっても試みられます。魚の放流後、 ブリーダーが飛び出して逃げないように、ハパの開口部はしっかりと閉じられています。ハパスの代わりに、 ハパスと同じ大きさのセメント貯水槽やプラスチックプールも繁殖に使用できます。
産卵は通常、2回目の注射後3〜6時間以内に発生します。受精後すぐに、 吸水により卵はかなり膨らみます。主要なコイの受精卵は透明な透明度の輝くガラスビーズのように見えますが、未受精卵は不透明で白っぽく見えます。異なるブリーダーの同じ種からの卵のサイズはかなり異なります。インドの主要な鯉の完全に腫れた卵は直径2.5mmで、 最大のものはカトラのものであり、最小のものはローフーのものです。コイの卵は非浮遊型、非粘着型です。卵黄には油滴がありません。インドの主要なコイは、大量の産卵能力を持っています。彼らの繁殖力、 平均して、 ローフーで3.1万ルピーです。 カトラで1〜3ラク、ミリガルで1.5ラク。
発育中の卵は、産卵後少なくとも4〜5時間は邪魔されずに繁殖ハパに保持され、卵が適切に水硬化されるようにします。この後、 マグカップを使ってハパから卵を集め、少量の水を入れたバケツに移します。その後、ブリーダーを取り出して体重を測定し、産卵前後の違いを調べます。これにより、産卵された卵の量がわかります。卵の総量と数は、サンプルマグの既知の量と卵の数から簡単に計算できます。受精卵の割合も、産卵の前後にランダムサンプリングを行うことによって評価されます。これにより、産卵された卵の量がわかります。卵の総量と数は、サンプルマグの既知の量と卵の数から簡単に計算できます。受精卵の割合も、ランダムサンプリングを実行することによってそれに応じて評価されます。
4 。 NS トライ NS ピン NS :
しかし、中国の鯉は自然に産卵せず、産卵するときに、 受精の割合は一般的に非常に低いです。したがって、ストリッピング(図3.1)または人工授精が続きます。雌の魚は、頭を上に傾け、尾を下に向け、腹を船に向けて保持されます。 そして、雌の体を押すことによって、卵はエナメルまたはプラスチックのトラフに集められます。その後、オスの魚も同様に保持され、ミルトが同じトラフに押し出されます。その後、配偶子は羽ペンを使ってできるだけ早く混合され、受精が可能になります。次に、受精卵をきれいな水で数回洗浄して余分な白子を取り除き、淡水で約30分間静置します。これで、卵は孵化タンクに放出する準備が整います。

NS e chn 私 qu e o NS NS NS tch 私 NS NS NS NS e e ggs :
繁殖ハパから集められた卵は孵化ハパに移されます。孵化したハパは、2つの別々のハパで構成されています。 外側のハパと内側のハパ。内側のハパはサイズが小さく、外側のハパの内側に取り付けられています。外側のハパは標準サイズの2x 1 x 1 mの薄い布で構成され、内側のハパは1.75 x 0.75 x 0.5mの寸法の丸いメッシュの蚊帳布で構成されています。外側と内側のハパのすべての角には、取り付けを容易にするためのループとロープが付いています。約75、 000対1 00、 000個の卵が各内側のハパの中に均一に広がっています。卵は24〜310℃の温度範囲で14〜20時間で孵化します。孵卵期間、 実際には、 温度に反比例します。孵化後、 孵化したばかりの子ガメは、内側のハパのメッシュを通って外側のハパに逃げます。孵化が完了すると取り除かれる卵殻と死んだ卵を含む内側のハパ。孵化したばかりの子ガメは、孵化後3日目まで邪魔されずに外側のハパに留まります。この期間中、 彼らは卵黄嚢に蓄えられた食物を食べています。 3日目までに口が形成され、孵化したばかりの子ガメは指示的な動きと摂食を開始します。この段階で、それらは外側の孵化ハパから注意深く集められ、準備された苗床に貯蔵されます。
インドの主要なコイは、同じ季節に2か月の間隔で2回産卵するように誘導される可能性があることがわかっています。最初の産卵後のブリーダーには、体重の2.5%で1:1の比率で落花生油粕と米ぬかが与えられます。良好な気候条件が発生した場合、 それらは成熟し、産卵の準備ができています。
の NS uce NS Br e edin NS w 私 NS NS H.C. NS 。
今日、下垂体抽出は、世界中で誘発された繁殖のための十分に確立された技術です。その大規模な使用は、下垂体(P.G)の利用可能性と品質に関して以下の問題を引き起こします。 P.G.の不十分な供給、 高コスト、 下垂体ゴナドトロピンの効力の変動性と悪意のあるP.G.による不正行為サプライヤー。これらの問題を克服するために、 ヒト絨毛性ゴナドトロピン(H.C.G)は、下垂体の代替物として発見されています。 H.C.G. 1927年の初めにアシュハイムとゾンデクによって発見されました。彼らは、妊婦の尿から黄体形成性生殖腺栄養活性を有する良質のホルモンを抽出しました。ロシアの労働者は、1964年にChoriogohinという商品名で絨毛性ゴナドトロピンを最初に使用し、ドジョウで良い結果を得ました。 Bratanor(1963)とGerbilski(1965)は、コイとマスにH.C.Gを使用し、大きな成功を収めました。 Tang(1968)は、中国のコイをC.G.と組み合わせて魚の下垂体で処理した場合、 誘発された繁殖に対する有効性が増加した。文献を熟読すると、H.C.G。単独で、またはP.G.と組み合わせて効果的です。世界中のさまざまな魚を誘発することで抽出します。
H.C.G.糖タンパク質またはシアロタンパク質であり、 炭水化物分子がタンパク質分子に付着しているためです。その主な機能は、黄体によるエストロゲンとプロゲステロンの産生を維持することです。胎盤によって産生され、妊娠の初期段階(2〜4か月)に尿から排泄されます。 H.C.Gは2つのサブユニットaとbで構成され、分子サイズは45、 000-50、 000ダルトン。その中には17個のアミノ酸があります、 そのうちアラニン、 プロリン、 セリン、 シスチンとヒスチジンは重要です。アミノ酸の数が多いため、 H.C.G.タンパク質含有量が高い。分子量は59と報告されています、 ゲルろ過による000および47、 沈降平衡による000。
妊娠初期のH.C.G.妊婦の尿が豊富です。 H.C.G.の抽出にはいくつかの方法が採用されています。 Aschheim and Zondek(1927)は、沈殿にエタノールを使用しました。カッツマンとカイナは異なる吸収剤を使用しました。市販の粗H.C.G抽出は、ゲルろ過で行われます。
下垂体の卵胞刺激ホルモン(FSH)と黄体形成ホルモン(LH)は、魚の正常な繁殖に重要な役割を果たします。 性腺の発達を促進する上で、 成長、 成熟度と産卵。 H.C.Gは、F.S.HおよびL.Hと性格および機能が多かれ少なかれ類似しています。下垂体は誘導された魚の繁殖に使用されるため、 H.C.Gは、性腺の早期成熟にも使用できます。 P.Gに対するH.C.Gの優位性は、次の理由で測定できます。魚はH.C.G.でより早く成熟します。 繁殖期の産卵はH.C.G.で増やすことができます。 H.C.G.スポーンのより良い生存を保証し、 それは、準備用量と最終用量の間の時間差を減らします。 H.C.Gはより経済的で、長い貯蔵寿命を持っています、 H.C.Gは、標準的なソースから簡単に入手できます。 したがって、より信頼性が高くなります。 年間を通してH.C.Gを定期的に注射することで、健康状態が改善され、体重と性腺の発達が促進されます。H.C.Gの効力は既知です(30 IU / mg)。 既知の重量のきちんとしたパケットで利用可能、 保存は含まれません、 偽りはできません、 H.C.Gで処理された魚は、同じ季節に誘発された繁殖に複数回使用できます。 孵化したばかりの子ガメの死亡率はごくわずかですが、 誘発された繁殖中の薬物の消費は少ない、 H.C.Gは成長ホルモンとして使用でき、繁殖期の終わりの卵の吸収はH.C.Gの投与によって比較的少なくなります。
粗H.C.Gは粉末状で、灰色がかった白色または淡黄色です。水に溶けやすいです。計算された量の粗H.C.Gを組織ホモジナイザーに取り、測定された蒸留水とともに5〜10分間撹拌します。 3〜5分間遠心分離します。 H.C.Gホルモンを含む透明な淡黄色がかった上澄み液を取り、すぐに注射します。使用が遅れると、効力が失われます。
ハクレン(Hypophthalmichthyes molitrix)の場合、 H.C.Gの使用は非常に成功していることがわかっています。投与量は4-6mg / kgです。男性の体重、 初回投与時および約6〜7時間後の6〜8 mg / kg体重、 良好な結果が得られた女性の2回目の投与の10〜12mg / kg体重。インドの主要なコイの繁殖にH.C.Gのみを使用しても、これまでのところ成功した結果は得られていません。インドの主要なコイとソウギョ(Ctenopharyngodon idella)の60-80%H.C.Gと40-20%P.Gの組み合わせが成功しています。 H.C.Gだけで繁殖するように誘導された魚はボラであり、 Cyprinus carpio、 Lctalurus punctatus、 Oreochromis nilotica、 Aristichthys nobilis、 ウェザーフィッシュ、 EsoxluciusとEpinephelustauvina。
最近の研究では、H.C.GとP.G. H.C.GまたはP.G単独よりもお勧めです。主要なコイと中国のコイの誘導繁殖のためにH.C.Gの投与量を標準化するには、さらに多くの作業を行う必要があります。
の NS uce NS ブリー NS の NS w それ NS O vapr 私 NS
下垂体の効力が変化するという問題のため、 代替案が試されました。さまざまな国で、黄体形成ホルモンの類似体を使用する試みがなされてきました。これは、さまざまな程度の成功を収めた魚の誘導繁殖のための放出ホルモン(LH-RH)です。しかし、 LH-RHで達成された成功は、常に一貫しているとは限りませんでした。 産卵を誘発するためのより高い線量要件は別として。この画期的な調査により、ほとんどの養殖魚の誘導繁殖のためのシンプルで効果的な技術を開発する道が開かれました。共同共同プロジェクトでは、 国際開発研究センターからの資金提供、 カナダから中国のリン博士とカナダのピーター博士へ、 魚を繁殖させるための信頼できる技術を開発するために、一連の調査が実施されました。彼らの調査は、「LNPE」法と呼ばれる新しい技術の開発につながりました。 ここで、LH-RHの類似体はドーパミン拮抗薬と組み合わされています。原則に基づいて、 M / s Syndel Laboratories Limited、 カナダはovaprimと呼ばれる新薬を製造しました。
Ovaprimはすぐに使用できる製品であり、溶液は周囲温度で安定しています。これには、20 µgのサーモンゴナドトロピン放出ホルモン(sGnPHa)の類似体とドーパミン拮抗薬が含まれています。 10mg / mlのドンペリドン。 ovaprimの効力は均一であり、LH-RHより17倍強力であることが知られているsGnRHaを含んでいます(Peter、 1987)。ドーパミン拮抗薬、 ovaprimで使用されるドンペリドンは、他の一般的に使用される拮抗薬よりも優れていると報告されています。 ピモジド。 Ovaprimはすぐに使用できる製品であり、冷蔵保管を必要としない製品です。 最も便利で効果的な排卵剤のようです。
この薬は、雌と雄の両方のひな魚に単回投与で同時に投与されます。 2回に分けて投与される下垂体抽出物とは異なります。これは、ひな魚の取り扱いを減らすだけでなく、種子生産のコストに追加されるかなりの時間と労力を節約するのにも役立ちます。処理された種の産卵反応は、下垂体抽出物を注入された種よりも優れていることがわかっています。
コイの誘導繁殖に対するオバプリムの効率は、カトラで非常に有望な結果をもたらしました。 ローフー、 mrigal、 ハクレン、 grass carp, big head, etc. The effective dose required for various species of carps is found to vary considerably. The common dose for all carps is 0.10-0.20 ml ovaprim/kg body weight of males and 0.25-0.80 ml ovaprim/kg body weight of females. Female catla is found to respond positively for a dose range of between 0.4-0.5 ml/kg, while rohu and mrigal respond to lower doses of 0.35 ml/kg and 0.25 ml/kg respectively. Among exotic carps, silver carp and grass carp are bred at doses ranging between 0.40-0.60 ml/kg. Big head carp bred successfully at 0.50 ml/ kg. For males of Indian carps, 0.10-0.15 ml/kg and for exotic male carps 0.15-0.20 ml/kg of dosages are found to be optimum. The method of injection is the same as pituitary.
In many countries including our country, ovaprim is used on a large scale for induced breeding of all cultivable fishes successfully.インドで、 initial trials were conducted during 1988 in Karnataka, Andhra Pradesh and Tamil Nadu.
Ovaprim has unique advantages over pituitary hormone – ready to use liquid form in 10 ml vial, consistent potency and reliable results, long shelf life, and can be stored at room temperature, formulated to prevent over dosing, male and female can be injected only once simultaneously, reduces handling and post breeding mortality, repeated spawning possible later in the season and high percentage of eggs, fertilization and hatching.
の NS uce NS br e edin NS w 私 NS NS o vati NS e
Ovatide is an indigenous, cost-effective and new hormonal formulation for induced breeding of fishes. The new formulation is having the base of a synthetic peptide which is structurally related to the naturally occuring hormone, goanadotropin releasing hormone (GnRH). GnRH is not a steroidal hormone and belongs to the class of organic substances called peptides. It is presented as a low viscosity injectable solution which is not only highly active but also cost-effective compared to other commercially available spawning agents. It is also effective in breeding major carps and catfishes. The doses for females are 0.20-0.40 ml/kg for rohu and mrigal, 0.40-0.50 ml/kg for catla, silver carp and grass carp and 0.20-0.30 ml/kg for calbasu. The dosages for males are 0.10-0.20 ml/kg for rohu, mrigal and calbasu, 0.20-0.30 ml/ kg for catla and 0.20-0.25 ml/kg for silver carp and grass carp.
The advantages of ovatide are:It is cost-effective hormonal preparation, it gives high fertilisation and hatching percentage (85-95%), it is increases egg production through complete spawning, it produces healthy seed, it is easy to inject due to its low viscosity, it does not cause adverse effects on brood fish after injection, it can be administered in a single dose to brooders, it can be stored at room temperature, it is quite effective even under climatic adversities and ovatide is available in the market as 10 ml vial, which costs Rs. 300. It is cheaper than ovaprim. The selection of brooders and injecting methods are similar to pituitary extract.
Ind u ce NS NS reedin NS 機転 NS Ovop e l
Ovopel, developed by the University of Godollo in Hungary, is a preparation containing mammalian GnRH and the water-soluble dopamine receptor antagonist, metoclopramide. The concentration of D-Ala6, Pro9NEt-mGnRH and metoclopramide are in the form of 18-20 micro gm/pellets and 8-10mg/pellets respectively. The hormone is thus available in pellet form. Each pellet contains superactive gonadoptropin releasing hypothalamic hormone analogue with an equal effect which a 3 mg normal acetone-dried dehydrated carp hypophysis gland has. Induced propagation of fish had been shown to be more effective if the hormone was administered in two doses, prime dose and resolving dose, as reported by Szabo, T., 1996. For cyprinids successful results were reported when 2-2.5 pellets/kg were administered to female brood fish.しかし、 preliminary trial with single injection of Ovopel gave encouraging result on a few species of Indian major carps and Clarias batrachus.
The required amount of ovopel was calculated on the basis of weight and condition of brood fish. The pellets were pulverized in a mortar and dissolved in distilled water. The trails were conducted in July-August of 1999.
The new inducing agent. ovopel is easy to store, simple to use and less expensive, as reported by Szabo. T, 1996. However, in India, detailed studies to establish its efficacy and economic viability are required to be undertaken. The hormone has been successfully tested for ovulation in several species of cyprinids, the Common carp, the Silver carp and the tench (Horvath et al, 1997) in Europe. Ovulation was also reported in African Cat fish (Brzuska, E. 1998).インドで、 Ovopel was used with success in induced breeding of major carps in UP, Haryana and Punjab. In Assam the trials conducted recently on Labeo rohita (Rohu), Cirrihinus mrigala (Mrigal), Labeo gonius (Gonius) and Clarias batrachus (Magur) gave encouraging results. This indicates the possibility of using this new hormone preparation for commercial production of fish seeds if made available to farmers at a competitive price.
O NS 彼 NS スー NS sta NS ce NS 我ら e NS NS o NS 私 NS duc e NS NS NS ee NS の NS
Other substances like LH-RH analogues, steroids, and clomiphene are used for induced breeding of fishes.
LH-R NS analo NS ue :
Various analogues of Luteinizing hormone -releasing hormone (LH-RH) have been used for induced breeding of fishes. Investigations have revealed that the potential action of releasing hormone when dopamine antagonist is simultaneously used with the analogues is (10-100 µg/kg) used successfully in China. An analogue of teleost GNRH is found to be more potent than LH-RH. GNRH (Gonadotropin releasing hormone) stimulates GTH(Gonadotropin hormone) in teleosts (dosage 25-100 µg/kg).
NS NS e roids:
Selected steroid hormones are used to induce fish. The effects of steroid hormones on ovulation are seen primarily as germinal vesicle breakdown (GVBD). Ovulated oocytes require at least 4 hours to become fertilisable in mullets, whereas in most of the fishes oocytes are fertilisable immediately. The action of pituitary gonadotropins on oocyte maturation is known to be mediated through steroid hormones. Deoxycorticosterone acetate (DOCA) and cortisone effectively stimulate (dosage 50 mg/kg of fish) ovulation in Heteropneustes fossilis (Goswamy and Sunderraj, 1971). 17á-hydroxy-20B dihydroprogesterone (17á-20BDP) is useful to induce gold fish, trout and pikes (Jalabert, 1973). Other steroid hormones commonly used for spawning teleosts are cortisone acetate, deoxycortisol, deoxycorticosterone, hydroxycortisone, progesterone, 11 deoxycorticosterone and 20B progesteron. The advantages of steroids are:most compounds are available as pure preparations in synthetic forms, the quality of steroid preparations is uniform and steroid hormones are much cheaper than gonadotropin preparations.
NS o miph e ne :
It is an analogue of the synthetic non-steroidal estrogen chlorotrianisene. It is known to have antiestrogenic effects in teleosts. It triggers the release of gonadotropins. The injections of clomiphene (10 µg/g) induced ovulation within 4 days in gold fish, whereas with same dosage, common carp spawned successfully after 40-64 hours.
E NS NS 私 NS NS NS 私 o NS o NS E NS NS NS :
The eggs are collected from the hapa by means of cup or tray or beaker and transferred to the buckets. The breeders are also removed from the hapa and their weights areoted. The difference in weights reveals approximately the number of eggs laid. The eggs are kept in a rectangular piece of close meshed mosquito net and allow the water to drain off. The eggs are measured in a beaker, mug or cup of known volume and transferred to hatcheries. Thus estimation of total quantity is made from total volume of the eggs measured. Percentage of fertilization can be arrived at by counting the number of fertilized eggs from egg samples of 1 ml measure.
NS NS ead 私 NS NS o NS NS o NS mo NS NS ar NS :
Common carp (Cyprinus carpio) generally breeds in confined water. Spawning takes place in shallow marginal, weed infected areas from January to March and from July to August. Common Carp is also observed to breed round the year. Controlled breeding of common carp is conducted to achieve better spawning and hatching. A set of selected brooders one female and two males are put together in breeding hapa. In order to ensure successful spawning sometimes the female fish is injected with pituitary gland extract at a low dose 2 to 3 mg per kg. Body weight. Freshly washed aquatic weeds (Hydrilla, Najas, Eichhornia etc) are uniformly distributed inside the hapa. These aquatic weeds act as egg collections. The quantity of weed used is roughly double the weight of the female introduced. Each weed attached with 40, 000 to 1, 00, 000 eggs are distributed into a single hatching hapa. After 4 or 5 days the weeds are taken out carefully.